Arbeitsgruppe: Translational Nuclear Medicine
Die Arbeitsgruppe Translational Nuclear Medicine beschäftigt sich mit der Translation präklinisch entwickelter Methodik in die klinische Molekulare Bildgebung und Radiotherapie.
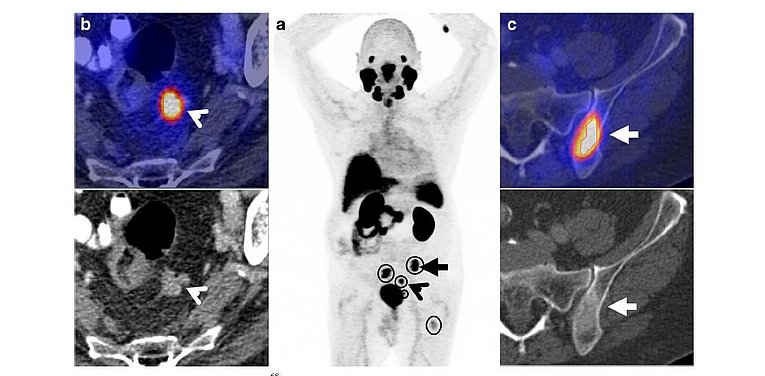
Radioliganden, die an das prostate-specific membrane antigen (PSMA) binden, haben die Diagnostik des Prostatakarzinoms und seiner Rezidive revolutioniert. Bisher gab es einschlägige Substanzen nur für die vergleichsweise kostspielige PET. Im Rahmen einer Kooperation mit den Firmen Progenics (Tarrytown, NY, USA) und ROTOP (Dresden) steht der Klinik mit dem Tc-99m-MIP 1404 ein Radiopharmakon für die SPECT/CT zur Verfügung. Dieses bisher nicht zugelassene Produkt konnte unter Maßgabe des §13(2b) AMG klinisch eingesetzt werden. Die durch die Arbeitsgruppe vorgenommene Analyse der primär aus klinischen Gründen erhobenen Bildgebungsdaten führte zu einer Vielzahl von Publikationen, die für den klinischen Einsatz der Substanz und derzeit geplante Zulassungsstudien einen wichtigen Ausgangspunkt liefern.
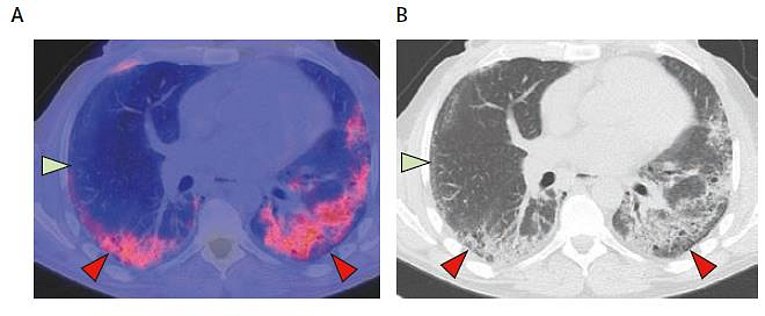
Bisher bei rheumatologischen Krankheiten eingesetzte nuklearmedizinisch-diagnostische Verfahren erfassen vor allem deren akut-entzündliche Aktivität. An das fibroblast activating protein (FAP) bindende PET-Tracer addressieren das bindegewebige Stroma von Tumoren und sind primär für die onkologische Diagnostik entwickelt worden. In Erlangen werden sie auch für die Darstellung fibrotisch aktivierter Prozesse bei rheumatischen Erkrankungen eingesetzt, da diese erheblichen Krankheitswert haben und mit neuen Substanzen auch therapeutisch adressierbar sind. Erste wissenschaftliche Arbeiten der Arbeitsgruppe belegen diesen Paradigmenwechsel von einer eher unspezifischen Entzündungsdarstellung zu einem pathogenetisch orientierten Fibroseimaging.
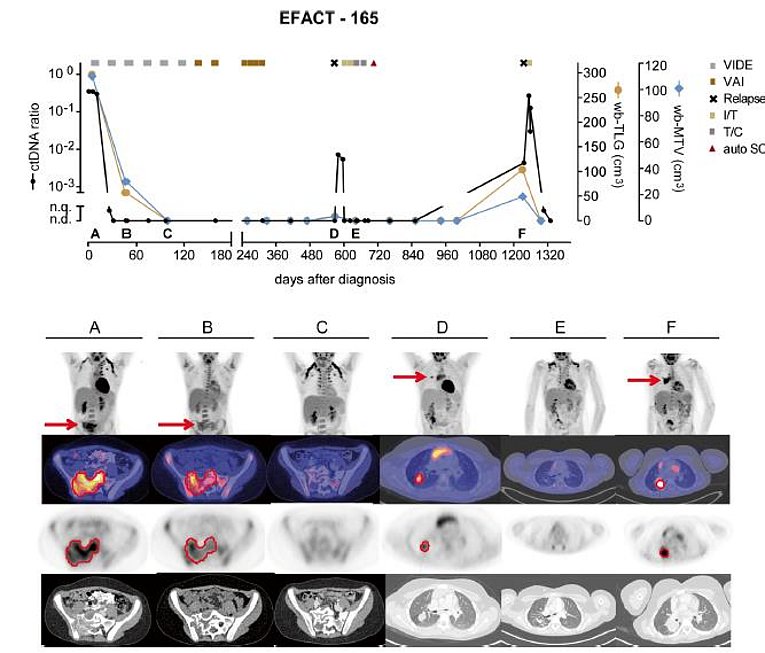
In einem interdisziplinären Forschungsprojekt mit der pädiatrischen Klinik des Universitätsklinikums Erlangen erfolgte die klinische Translation der bisher nur präklinisch genutzten zirkulierenden Tumor-DNA als Tumormarker zur frühzeitigen Detektion eines Ewing-Sarkom-Rezidiv. Hierfür wird die Kombination der aus dem Blut gewonnenen zirkulierenden Tumor-DNA die als Marker für ein Tumorrezidiv fungiert, sowie der 18F-FDG PET/CT als bildgebendes Verfahren zur Rezidivlokalisation genutzt. Dies stellt ein neuartiges Verfahren dar, da spezifische Tumormarker für das Ewing-Sarkom bisher klinisch nicht verfügbar waren. Zukünftig soll diese Kombination aus Bildgebung und molekularer DNA-Analyse das Tumorrezidiv möglichst frühzeitig im Körper lokalisieren und somit einer gezielten Behandlung zuzuführen, um die Prognose der Patienten zu verbessern.
Die Abschätzung der im Rahmen der nuklearmedizinischen Radionuklidtherapien deponierten Strahlendosen im Tumorgewebe stellt aufgrund der Tumorheterogenität und der patientenindividuellen Stoffwechsel- und Ausscheidungskinetik eine Herausforderung dar. In der nuklearmedizinischen Klinik konnten, in Zusammenarbeit mit der Universtität Regensburg, Algorithmen der künstlichen Intelligenz entwickelt werden, um genauere Abschätzungen von Strahlendosen im Tumorgewebe und in kritischen Organen, wie der Niere zu ermöglichen. Durch den Einsatz von Monte-Carlo Simulationen, ist es gelungen eine patientenindividuelle, im Vergleich zur bisher genutzten MIRD Standardmethode genauere, voxelweise Dosisabschätzung zu erreichen und diese in der Planung von nuklearmedizinischen Therapien einzusetzen.
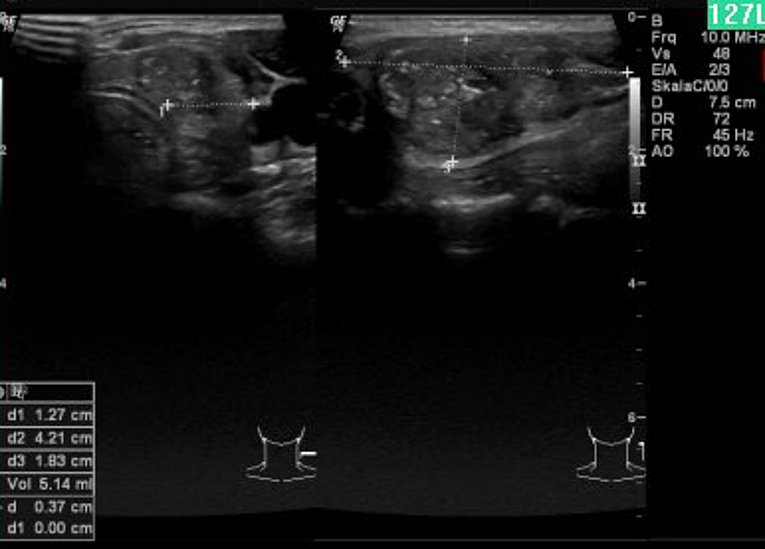
Die Nuklearmedizin leistet einen wesentlichen Beitrag zur interdisziplinären Diagnostik und Therapie von Tumorerkrankungen der Schilddrüse. Ein hoher Stellenwert kommt der Ultraschalluntersuchung sowohl in der initialen Diagnostik als auch in der Nachsorge von Patienten mit Schilddrüsentumoren zu.
Für die sonographische Klassifizierung von Schilddrüsenknoten werden verschiedene Scoring Systeme verwendet. Allerdings lassen sich durch deren Anwendung nur Wahrscheinlichkeitsaussagen zur Dignität der Knoten treffen.
Mit Hilfe von Verfahren der künstlichen Intelligenz soll ermittelt werden, ob durch eine komplexe multifaktorielle Analyse von Ultraschallmarkern zuverlässige Aussagen zu Eigenschaften von Neoplasien der Schilddrüse im Hinblick auf Proliferation, Invasivität und Aggressivität herzustellen sind. Berücksichtigung finden bei diesem analytischen Vorgehen auch molekulare Marker, die einen Einfluss auf das Tumorverhalten haben können. Hierdurch soll eine Optimierung von Behandlungsstrategien ermöglicht werden, um das rezidivfreie Überleben der Patienten zu verbessern.